Sve o iridiju

Većina ljudi ima prilično dobru ideju o željezu i aluminiju, srebru i zlatu. No, postoje kemijski elementi koji igraju nešto manju ulogu u životu suvremenog svijeta, ali su među nespecijalistima nezasluženo malo poznati. Važno je ispraviti ovaj nedostatak, uključujući i naučiti sve o tome iridija.


Osobitosti
Treba odmah reći da iridij je metal. Stoga ima sva svojstva koja su tipična za druge metale. Takav kemijski element označava se kombinacijom latinskih znakova Ir. U periodnom sustavu zauzima Kavez 77. Otkriće iridija dogodilo se 1803. godine, u sklopu iste studije u kojoj je i engleski znanstvenik Tennant izolirao osmij.
Početna sirovina za proizvodnju takvih elemenata bila je ruda platine dopremljena iz Južne Amerike. U početku su metali izolirani u obliku taloga, koji "kraljeva voda" nije preuzela. Studija je otkrila prisutnost nekoliko dosad nepoznatih tvari. Element je dobio svoju verbalnu oznaku jer njegove soli izgledaju kao da prelijevaju dugu.
Sadržaj iridija u prirodi je izuzetno mali, a jedna je od najrjeđih tvari na Zemlji.


Kemijski čisti iridij nema duginu boju. Ali karakterizira ga prilično atraktivna srebrno-bijela boja. Toksična svojstva nisu potvrđena. Međutim, određeni spojevi iridija mogu biti opasni za ljude. Posebno je otrovan fluor ovog elementa.
Niz ruskih i stranih poduzeća uključeno je u proizvodnju i rafinaciju iridija. Gotovo cjelokupna proizvodnja ovog metala je proizvod poprečne obrade platinastih sirovina. Iako iridij nije ljubičast, on prirodno sadrži 2 izotopa. Elementi 191 i 193 su stabilni.No, određeni broj umjetno dobivenih izotopa ima izražena radioaktivna svojstva, njihov poluživot je kratak.


Svojstva
Fizički
Čvrstoća i tvrdoća iridija je vrlo velika. Taj metal je gotovo nemoguće mehanički obraditi. Infuzibilnost ovaj element je srebrno bijele boje je dovoljno velik. Specijalisti uključuju iridij u skupinu platine. Tvrdoća po Mohsovoj ljestvici je 6,5. Talište u stupnjevima doseže 2466 stupnjeva. Iridij, međutim, počinje ključati tek na 4428 stupnjeva. Toplina fuzije je 27610 J/mol. Toplina ključanja - 604000 J / mol. Stručnjaci su odredili molarni volumen na 8,54 kubičnih metara. vidjeti za krticu.
Kristalna rešetka ovog elementa je kubična, rubovi kristala su vrhovi kocke. 191. izotop čini 37,3% atoma iridija. Preostalih 62,3% predstavlja 193. izotop. Gustoća ovog elementa (ili inače, specifična težina) doseže 22400 kg po 1 m3.
U svom čistom obliku, metal se ne magnetizira, a oksidacijsko stanje atoma u različitim spojevima kreće se od 1 do 6.


Kemijski
Ali sami atomi iridija rijetko ulaze u bilo kakve reakcije. Ovaj element odlikuje se izvanrednom kemijskom pasivnošću.... Potpuno je netopiv u vodi i ne mijenja se ni nakon duljeg kontakta sa zrakom. Ako je temperatura neke tvari manja od 100 stupnjeva, ona neće reagirati ni s kraljevskom akvama, a kamoli drugim kiselinama i njihovim kombinacijama. Reakcija s fluorom je moguća na 400 stupnjeva, za reakciju s klorom ili sumporom potrebno je zagrijati iridij dok ne postane crven.
Poznata su 4 klorida u kojima broj atoma klora varira od 1 do 4. Učinak kisika vidljiv je na temperaturama ne nižim od 1000 stupnjeva. Produkt ove interakcije je iridijev dioksid, tvar praktički netopiva u vodi. Topljivost se može povećati oksidacijom korištenjem agensa za stvaranje kompleksa. Najveće oksidacijsko stanje u normalnim uvjetima može se postići samo u iridij heksafluoridu.


Pri ekstremno niskim temperaturama pojavljuju se spojevi s valencijama 7 i 8. Moguće je stvaranje kompleksnih soli (kationskih i anionskih). Primjećuje se da jako zagrijani metal može korodirati klorovodičnu kiselinu zasićenu kisikom. Kemičari pridaju važnu ulogu:
- hidroksidi;
- kloridi;
- halogenidi;
- oksid;
- do iridijevih karbonila.


Kako se minira?
Dobivanje iridija u prirodi uvelike otežava njegova velika rijetkost. U prirodnom okruženju ovaj metal se uvijek miješa sa srodnim tvarima. Ako se ovaj element nađe bilo gdje, onda se u blizini moraju naći platina ili metali iz njegove skupine. Neke rude koje sadrže nikal i bakar uključuju iridij u raspršenom obliku. Glavni dio ovog elementa ekstrahira se iz inertne tvari u:
- JUŽNA AFRIKA;
- Kanada;
- sjevernoamerička država Kalifornija;
- nalazišta na otoku Tasmaniji (u vlasništvu Australske unije);
- Indonezija (na otoku Kalimantan);
- različita područja otoka Nove Gvineje.

Iridij pomiješan s osmijem kopa se u starim planinskim naborima koji se nalaze u istim zemljama. Tvrtke iz Južna Afrika... Nije uzalud da proizvodnja u ovoj zemlji izravno utječe na ravnotežu ponude i potražnje, što se ne može reći za proizvode iz drugih regija planeta. Prema postojećim znanstvenim konceptima, rijetkost iridija je posljedica činjenice da je na naš planet došao samo u meteoritima, pa stoga čini milijunti dio postotka mase zemljine kore.
Međutim, neki stručnjaci se s tim ne slažu. Inzistiraju da je samo mali dio svih nalazišta iridija istražen i pogodan za razvoj na razini suvremenih tehnologija. Sedimenti, koji su se pojavili u dubokoj geološkoj antici, sadrže u zasebnim slojevima iridija stotine puta više od stijena koje se već iskopavaju.
Takve se anomalije nalaze diljem svijeta. Međutim, vađenje materijala iz dubokih dijelova ispod kontinenata i na dnu oceana i dalje je ekonomski neracionalno.


Danas se iridij vadi tek nakon završetka ekstrakcije glavnih minerala.... To su zlato, nikal, platina ili bakar. Kada je ležište blizu iscrpljivanja, ruda se počinje prerađivati posebnim reagensima koji oslobađaju rutenij, osmij i paladij. Tek nakon njih dolazi red na primanje elementa "duge". Unaprijediti:
- rafiniranje rude;
- zdrobiti ga u prah;
- ovaj prah se preša;
- prešani obradaci se pretapaju u električnim pećima, uz kontinuirano kretanje mlaza argona.
Prilično velika količina metala dobiva se iz anodnog mulja koji je ostao pri proizvodnji bakra i nikla. U početku se mulj obogaćuje. Platina i drugi metali, uključujući iridij, pretvaraju se u otopinu pod djelovanjem vruće aqua regia. Osmij završava u neotopljenom sedimentu. Iz otopine se pod djelovanjem amonijevog klorida sukcesivno talože kompleksi platine, iridija i rutenija.


Primjena
Otkopano je oko 66% iridija koristi se u kemijskoj industriji... Svi ostali sektori gospodarstva dijele ostatak. Posljednjih desetljeća vrijednost nakita "ljubičastog metala" stalno raste.... Od kasnih 1990-ih od njega se povremeno izrađuje prstenje i intarzirani zlatni nakit. Važno: nakit se ne izrađuje toliko od čistog iridija koliko od njegove legure s platinom. Dodatak od 10% dovoljan je za povećanje čvrstoće obratka i gotovog proizvoda do 3 puta bez značajnog povećanja troškova.
U drugim industrijama legure iridija također su očito ispred čistog metala. Tehnolozi vrlo cijene sposobnost povećanja tvrdoće i čvrstoće proizvoda manjim dodatkom. Stoga se aditivi iridija koriste za povećanje otpornosti na habanje žice za elektroničke cijevi. Tvrdi metal se jednostavno polaže preko molibdena ili volframa. Naknadno sinteriranje se odvija pod prešom na visokoj temperaturi.


I ovdje je potrebno posebno reći o upotrebi iridija u kemijskoj industriji. Tamo su njegove legure potrebne za dobivanje posuđa otpornih na različite reagense i visoke temperature. Iridij se također pokazuje kao izvrstan katalizator. Posebno je vidljivo povećanje reaktivnosti u proizvodnji dušične kiseline... A ako trebate otopiti zlato u aqua regia, tada će tehnolozi gotovo zajamčeno odabrati upravo šalice izrađene od legure platine i iridija.
Gdje kuhaju kristali za laserske uređaje, često možete pronaći platina-iridijeve lončiće. Potpuno čisti metal prikladan je za dijelove visokopreciznih industrijskih i laboratorijskih instrumenata. Koristi se iridij usnik i staklarikada trebaju napraviti vatrostalno staklo. Ali ovo je samo mali dio primjene nevjerojatnog elementa.
Često se koristi u proizvodnji svjećica za automobile.


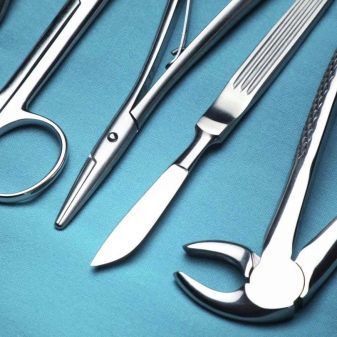
Stručnjaci su odavno primijetili da takve svijeće traju dulje.... Na samom početku korišteni su prvenstveno za sportske automobile. Danas su postali jeftiniji i dostupni su gotovo svim vlasnicima automobila. Legure iridija također su potrebne kreatorima kirurški instrumenti... Sve se više koriste u izradi pojedinih dijelova pacemakera.
Zanimljivo je da je novčić “10 franaka” proizveden u Ruandi izrađen od iridija kvalitete dragog kamenja (standard 999). Ovaj metal se također koristi u automobilskim katalizatorima. Poput platine, pomaže ubrzati pročišćavanje ispušnih plinova. Ali iridij možete pronaći u najčešćem nalivperu. Tamo ponekad možete vidjeti kuglicu neobične boje, koja se nalazi na vrhu olovke ili tinte.

Iridij se prije nekoliko desetljeća uglavnom koristio u radio komponentama. Od njega su se češće izrađivale kontaktne grupe, kao i komponente koje mogu biti jako vruće.Ovo rješenje omogućuje vam da osigurate trajnost proizvoda. Izotop iridij-192 jedan je od umjetnih radionuklida. Proizveden je za nerazornu uporabu za provjeru karakteristika zavarenih spojeva, čelika i aluminijskih legura.
Za izradu se koristi legura osmija s iridijem igle kompasa. A termoelementi, koji kombiniraju iridij i konvencionalne elektrode, koriste se za fizikalna istraživanja. Samo oni mogu izravno registrirati temperaturu od oko 3000 stupnjeva. Cijena takvih struktura je vrlo visoka. Nije ekonomski isplativo koristiti ih u konvencionalnoj industriji.


Iridij titan elektroda - jedan od relativno novih razvoja u području elektrolize. Vatrostalna tvar se raspršuje na podlogu od titanske folije. U ovom slučaju u radnoj komori je samo argon. Elektrode mogu izgledati kao rešetka ili ploča. Takve elektrode:
- otporan na visoke temperature;
- otporan na značajan napon, gustoću i struju;
- ne korodiraju;
- ekonomičniji od elektroda s dodatkom platine (zbog znatno dužeg resursa).

Mali spremnici s radioaktivnim izotopima iridija traženi su u metalurgiji. Gama zrake djelomično apsorbira naboj. Stoga je moguće odrediti kolika je razina punjenja unutar peći.
Također možete ukazati na takve primjene 77. elementa kao što su:
- dobivanje slitina molibdena i volframa, koje su jače na visokim temperaturama;
- povećanje otpornosti titana i kroma na kiseline;
- proizvodnja termoelektričnih generatora;
- proizvodnja termoionskih katoda (zajedno s lantanom i cerijem);
- stvaranje spremnika goriva za svemirske rakete (legirane hafnijem);
- proizvodnja propilena na bazi metana i acetilena;
- dodatak platinskim katalizatorima za proizvodnju dušikovih oksida (prekursora dušične kiseline) - ali ovaj tehnološki proces više nije previše relevantan;
- dobivanje referentnih mjernih jedinica (točnije, za to je potrebna legura platine i iridija).

Zanimljivosti
Iridijeve soli su vrlo raznolike boje. Dakle, ovisno o broju dodanih atoma klora, spoj može imati bakrenocrvenu, tamnozelenu, maslinastu ili smeđu boju. Iridij difluorid je obojen žuto. Spojevi s ozonom i bromom su plave boje. Čisti iridij ima vrlo visoku otpornost na koroziju čak i kada se zagrije na 2000 stupnjeva.
U stijenama kopnenog podrijetla koncentracija spojeva iridija je vrlo niska.... Značajno se povećava samo u stijenama meteoritskog podrijetla. Ovaj kriterij omogućuje istraživačima da utvrde važne činjenice o različitim geološkim strukturama. Na Zemlji se proizvodi samo nekoliko tona iridija.
Youngov modul (aka modul uzdužne elastičnosti) ovog metala je na drugom mjestu među poznatim tvarima (više - samo za grafen).


Za ostala svojstva i namjene iridija pogledajte sljedeći video.








